Fortbildungen
Hier finden Sie alle unsere aktuellen Fortbildungen.
Wir bieten Ihnen ein breites Spektrum zertifizierter CME zu den unterschiedlichsten Themen und Fachgebieten.
Mit Abschluss eines Wissenstests können Sie 2-4 CME-Punkte sammeln.
Intraoralscanner in der Diagnostik: Mehrwert oder Spielerei?
Kategorie: Zahnmedizin
Mögliche CME-Punkte: 2
Zertifizierende Stelle: 0
Mit freundlicher Unterstützung von teamwork
Gesponsert von mgo fachverlage GmbH & Co. KG
Weiterempfehlen: 


Fettverteilungsstörung Lipödem: Krankheitsbild und Behandlung
Kategorie: Allgemeinmedizin
Mögliche CME-Punkte: 2
Zertifizierende Stelle: Bayerische Landesärztekammer
Mit freundlicher Unterstützung von Der Allgemeinarzt
Weiterempfehlen: 


Glaukommanagement in der Schwangerschaft, Teil 2
Kategorie: Ophthalmologie
Mögliche CME-Punkte: 2
Zertifizierende Stelle: Bayerische Landesärztekammer
Mit freundlicher Unterstützung von CONCEPT Ophthalmologie
Gesponsert von Westermayer Verlags-GmbH; Betrag: € 300,-
Weiterempfehlen: 

Welchen Einfluss hat die PSMA-PET/CT auf unsere Therapie-Entscheidungen?
Kategorie: Urologie
Mögliche CME-Punkte: 2
Zertifizierende Stelle: Bayerische Landesärztekammer
Mit freundlicher Unterstützung von UroForum
Weiterempfehlen: 

Kurze präoperative endokrine Therapien – was bringt das? Die endokrine Induktionstherapie beim HR+ Mammakarzinom
Kategorie: Gynäkologie
Mögliche CME-Punkte: 4
Zertifizierende Stelle: Bayerische Landesärztekammer
Mit freundlicher Unterstützung von gynäkologische praxis
Gesponsert von Westermayer Verlags-GmbH; Betrag: € 500,-
Weiterempfehlen: 


Quo vadis THS: Alte und neue Herausforderungen bei der Programmierung der subthalamischen Tiefen Hirnstimulation beim Parkinson Erkrankten
Kategorie: Neurologie
Mögliche CME-Punkte: 2
Zertifizierende Stelle: Bayerische Landesärztekammer
Mit freundlicher Unterstützung von neuro aktuell
Weiterempfehlen: 


Diagnostik und Behandlung der Bronchiektasenkrankheit heute
Kategorie: Innere Medizin
Mögliche CME-Punkte: 4
Zertifizierende Stelle: Bayerische Landesärztekammer
Mit freundlicher Unterstützung von internistische praxis
Gesponsert von Westermayer Verlags-GmbH; Betrag: € 500,-
Weiterempfehlen: 


Individualisierte Therapie des Typ-2-Diabetes
Kategorie: Innere Medizin
Mögliche CME-Punkte: 2
Zertifizierende Stelle: Bayerische Landesärztekammer
Mit freundlicher Unterstützung von herzmedizin
Gesponsert von Westermayer Verlags-GmbH; Betrag: € 300,-
Weiterempfehlen: 


Verzögerte kognitive Erholung und persistierende kognitive Funktionsstörungen nach einem Delir
Kategorie: Neurologie
Mögliche CME-Punkte: 2
Zertifizierende Stelle: Bayerische Landesärztekammer
Mit freundlicher Unterstützung von neuro aktuell
Gesponsert von Westermayer Verlags-GmbH; Betrag: € 300,-
Weiterempfehlen: 


Diabetes mellitus im Kindes- und Jugendalter: Leitlinie Typ-1-Diabetes - was ist neu?
Kategorie: Allgemeinmedizin
Mögliche CME-Punkte: 2
Zertifizierende Stelle: Bayerische Landesärztekammer
Mit freundlicher Unterstützung von Der Allgemeinarzt
Gesponsert von Westermayer Verlags-GmbH; Betrag: € 300,-
Weiterempfehlen: 


Differenzialdiagnose bei Hüftschmerzen: Wann zum Spezialisten
Kategorie: Allgemeinmedizin
Mögliche CME-Punkte: 2
Zertifizierende Stelle: Bayerische Landesärztekammer
Mit freundlicher Unterstützung von Der Allgemeinarzt
Gesponsert von Westermayer Verlags-GmbH; Betrag: € 300,-
Weiterempfehlen: 

Perioperative Therapie beim primär operablen nicht-kleinzelligen Lungenkarzinom
Kategorie: Onkologie
Mögliche CME-Punkte: 2
Zertifizierende Stelle: Bayerische Landesärztekammer
Mit freundlicher Unterstützung von onkologie heute
Gesponsert von Westermayer Verlags-GmbH; Betrag: € 300,-
Weiterempfehlen: 


Die genderinklusive gynäkologische Praxis
Kategorie: Gynäkologie
Mögliche CME-Punkte: 2
Zertifizierende Stelle: Bayerische Landesärztekammer
Mit freundlicher Unterstützung von gyne
Gesponsert von Westermayer Verlags-GmbH; Betrag: € 300,-
Weiterempfehlen: 


Das trockene Auge im Alter
Kategorie: Ophthalmologie
Mögliche CME-Punkte: 2
Zertifizierende Stelle: Bayerische Landesärztekammer
Mit freundlicher Unterstützung von CONCEPT Ophthalmologie
Gesponsert von Westermayer Verlags-GmbH; Betrag: € 300,-
Weiterempfehlen: 

Akuter und chronischer Husten
Kategorie: Allgemeinmedizin
Mögliche CME-Punkte: 2
Zertifizierende Stelle: Ärztekammer Rheinland-Pfalz/Akademie für Ärztliche Fortbildung in Rheinland-Pfalz
Mit freundlicher Unterstützung von Der Allgemeinarzt
Weiterempfehlen: 

Es bleibt kompliziert
Kategorie: Allgemeinmedizin
Mögliche CME-Punkte: 2
Zertifizierende Stelle: Ärztekammer Rheinland-Pfalz/Akademie für Ärztliche Fortbildung in Rheinland-Pfalz
Mit freundlicher Unterstützung von Der Allgemeinarzt
Weiterempfehlen: 


L-T4/L-T3-Kombinationstherapie?
Kategorie: Allgemeinmedizin
Mögliche CME-Punkte: 3
Zertifizierende Stelle: Ärztekammer Rheinland-Pfalz/Akademie für Ärztliche Fortbildung in Rheinland-Pfalz
Mit freundlicher Unterstützung von Der Allgemeinarzt
Weiterempfehlen: 

Hautkrebs-Screening in der Allgemeinpraxis
Kategorie: Allgemeinmedizin
Mögliche CME-Punkte: 2
Zertifizierende Stelle: Ärztekammer Rheinland-Pfalz/Akademie für Ärztliche Fortbildung in Rheinland-Pfalz
Mit freundlicher Unterstützung von Der Allgemeinarzt
Weiterempfehlen: 


Endokrine Orbitopathie
Kategorie: Allgemeinmedizin
Mögliche CME-Punkte: 2
Zertifizierende Stelle: Ärztekammer Rheinland-Pfalz/Akademie für Ärztliche Fortbildung in Rheinland-Pfalz
Mit freundlicher Unterstützung von Der Allgemeinarzt
Weiterempfehlen: 


"Gebrauchsanweisung" für die COPD-Therapie
Kategorie: Allgemeinmedizin
Mögliche CME-Punkte: 2
Zertifizierende Stelle: Ärztekammer Rheinland-Pfalz/Akademie für Ärztliche Fortbildung in Rheinland-Pfalz
Mit freundlicher Unterstützung von Der Allgemeinarzt
Weiterempfehlen: 

Impfprävention RSV
Kategorie: Allgemeinmedizin
Mögliche CME-Punkte: 2
Zertifizierende Stelle: Ärztekammer Rheinland-Pfalz/Akademie für Ärztliche Fortbildung in Rheinland-Pfalz
Mit freundlicher Unterstützung von Der Allgemeinarzt
Weiterempfehlen: 

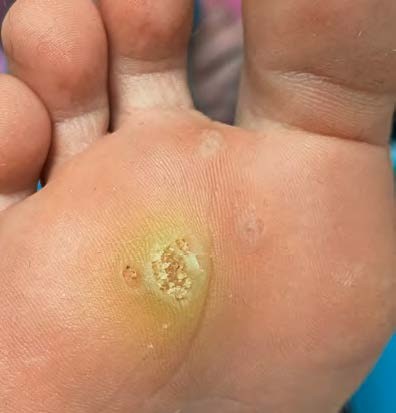
Was tun bei Hautwarzen?
Kategorie: Allgemeinmedizin
Mögliche CME-Punkte: 2
Zertifizierende Stelle: Ärztekammer Rheinland-Pfalz/Akademie für Ärztliche Fortbildung in Rheinland-Pfalz
Mit freundlicher Unterstützung von Der Allgemeinarzt
Weiterempfehlen: 

Neurodermitis: Neues, Gesichertes, Praktisches
Kategorie: Allgemeinmedizin
Mögliche CME-Punkte: 2
Zertifizierende Stelle: Bayerische Landesärztekammer
Mit freundlicher Unterstützung von Der Allgemeinarzt
Gesponsert von Westermayer Verlags-GmbH; Betrag: € 300,-
Weiterempfehlen: 

Gebrauchsanweisung zur Asthmatherapie
Kategorie: Allgemeinmedizin
Mögliche CME-Punkte: 2
Zertifizierende Stelle: Ärztekammer Rheinland-Pfalz/Akademie für Ärztliche Fortbildung in Rheinland-Pfalz
Mit freundlicher Unterstützung von Der Allgemeinarzt
Weiterempfehlen: 

Harnblasenfunktionsstörungen alternder Männer: LUTS, OAB und andere Ursachen
Kategorie: Urologie
Mögliche CME-Punkte: 2
Zertifizierende Stelle: Bayerische Landesärztekammer
Mit freundlicher Unterstützung von UroForum
Gesponsert von Westermayer Verlags-GmbH; Betrag: € 300,-
Weiterempfehlen: 

Herzinsuffizienz und Niere: Was muss der Kardiologe über die Niere und ihre Funktion wissen?
Kategorie: Innere Medizin
Mögliche CME-Punkte: 2
Zertifizierende Stelle: Bayerische Landesärztekammer
Mit freundlicher Unterstützung von herzmedizin
Gesponsert von Westermayer Verlags-GmbH; Betrag: € 300,-
Weiterempfehlen: 


Autismus(-Spektrum-Störung): diagnostisches Vorgehen bei Erwachsenen
Kategorie: Neurologie
Mögliche CME-Punkte: 2
Zertifizierende Stelle: Bayerische Landesärztekammer
Mit freundlicher Unterstützung von neuro aktuell
Gesponsert von Westermayer Verlags-GmbH; Betrag: € 300,-
Weiterempfehlen: 

Transparenzinformation:
Die Bundesärztekammer und die Bayerische Landesärztekammer fordern auf, mehr Transparenz bei der Förderung von ärztlichen Fortbildungen bzw. CME zu schaffen. Fortbildungsveranstalter sind gehalten, potenzielle Teilnehmer von Fortbildungen darüber zu informieren, in welchem Umfang und zu welchen Bedingungen die (Arzneimittel-)Industrie die Veranstaltung unterstützt. Dieser Verpflichtung kommen wir nach und informieren Sie hier über die Höhe der Förderung der beteiligten (Arzneimittel-)Firma sowie über mögliche Interessenkonflikte der Autoren.
Diese Fortbildung bzw. CME erhielt für den aktuellen Zertifizierungszeitraum eine finanzielle Förderung von: Westermayer Verlag-GmbH mit 300 €.
Interessenkonflikte des Autors: Bei der Erstellung dieser von der Bayerischen Landesärztekammer zertifizierten Fortbildung bzw. CME bestanden keine Interessenkonflikte im Sinne der Empfehlungen des International Committee of Medical Journal Editors (www.icmje.org). Relevant ist der Zeitraum der letzten zwei Jahre vor Einreichen der Fortbildung bzw. CME durch Mediengruppe Oberfranken – Fachverlage GmbH & Co. KG bei der Bayerischen Landesärztekammer. Diese Angaben erfolgen selbstverantwortlich durch die Autoren.
Wissenschaftliches Lektorat und neutrale Gutachter: Aktualität der medizinischen Inhalte, Produktneutralität und Werbefreiheit dieser Fortbildung bzw. CME wurden im Vorfeld der Zertifizierung bei der Bayerischen Landesärztekammer durch ein wissenschaftliches Lektorat und ein Review mit zwei Gutachtern geprüft.
Zerebrospinale Metastasierung beim Mammakarzinom aus radio-onkologischer Perspektive
Kategorie: Onkologie
Mögliche CME-Punkte: 2
Zertifizierende Stelle: Bayerische Landesärztekammer
Mit freundlicher Unterstützung von onkologie heute
Gesponsert von Westermayer Verlags-GmbH; Betrag: € 300,-
Weiterempfehlen: 

Das diabetische Fußsyndrom
Kategorie: Allgemeinmedizin
Mögliche CME-Punkte: 2
Zertifizierende Stelle: Bayerische Landesärztekammer
Mit freundlicher Unterstützung von Der Allgemeinarzt
Gesponsert von Westermayer Verlags-GmbH; Betrag: € 300,-
Weiterempfehlen: 


Hypogonadismus bei Männern
Kategorie: Allgemeinmedizin
Mögliche CME-Punkte: 2
Zertifizierende Stelle: Bayerische Landesärztekammer
Mit freundlicher Unterstützung von Der Allgemeinarzt
Gesponsert von Westermayer Verlags-GmbH; Betrag: € 300,-
Weiterempfehlen: 

Kognitive Verschlechterung nach einem Schlaganfall: was kann dahinterstecken?
Kategorie: Neurologie
Mögliche CME-Punkte: 2
Zertifizierende Stelle: Bayerische Landesärztekammer
Mit freundlicher Unterstützung von neuro aktuell
Gesponsert von Westermayer Verlags-GmbH; Betrag: € 300,-
Weiterempfehlen: 

Transparenzinformation:
Die Bundesärztekammer und die Bayerische Landesärztekammer fordern auf, mehr Transparenz bei der Förderung von ärztlichen Fortbildungen bzw. CME zu schaffen. Fortbildungsveranstalter sind gehalten, potenzielle Teilnehmer von Fortbildungen darüber zu informieren, in welchem Umfang und zu welchen Bedingungen die (Arzneimittel-)Industrie die Veranstaltung unterstützt. Dieser Verpflichtung kommen wir nach und informieren Sie hier über die Höhe der Förderung der beteiligten (Arzneimittel-)Firma sowie über mögliche Interessenkonflikte der Autoren.
Diese Fortbildung bzw. CME erhielt für den aktuellen Zertifizierungszeitraum eine finanzielle Förderung von: Westermayer Verlag-GmbH mit 300 €.
Interessenkonflikte des Autors: Bei der Erstellung dieser von der Bayerischen Landesärztekammer zertifizierten Fortbildung bzw. CME bestanden keine Interessenkonflikte im Sinne der Empfehlungen des International Committee of Medical Journal Editors (www.icmje.org). Relevant ist der Zeitraum der letzten zwei Jahre vor Einreichen der Fortbildung bzw. CME durch Mediengruppe Oberfranken – Fachverlage GmbH & Co. KG bei der Bayerischen Landesärztekammer. Diese Angaben erfolgen selbstverantwortlich durch die Autoren.
Wissenschaftliches Lektorat und neutrale Gutachter: Aktualität der medizinischen Inhalte, Produktneutralität und Werbefreiheit dieser Fortbildung bzw. CME wurden im Vorfeld der Zertifizierung bei der Bayerischen Landesärztekammer durch ein wissenschaftliches Lektorat und ein Review mit zwei Gutachtern geprüft.

Die aktuelle Sturzleitlinie und ihre Implementierung in den Alltag
Kategorie: Innere Medizin
Mögliche CME-Punkte: 4
Zertifizierende Stelle: Bayerische Landesärztekammer
Mit freundlicher Unterstützung von internistische praxis
Gesponsert von Westermayer Verlags-GmbH; Betrag: € 500,-
Weiterempfehlen: 


Management von chronischen Schmerzen im Kindes- und Jugendalter
Kategorie: Pädiatrie
Mögliche CME-Punkte: 4
Zertifizierende Stelle: Bayerische Landesärztekammer
Mit freundlicher Unterstützung von pädiatrische praxis
Gesponsert von Westermayer Verlags-GmbH; Betrag: € 500,-
Weiterempfehlen: 

Fetale Lungenfehlbildungen. Pränatale Therapiemöglichkeiten bei diversen fetalen Lungenfehlbildungen
Kategorie: Gynäkologie
Mögliche CME-Punkte: 4
Zertifizierende Stelle: Bayerische Landesärztekammer
Mit freundlicher Unterstützung von gynäkologische praxis
Gesponsert von Westermayer Verlags-GmbH; Betrag: € 500,-
Weiterempfehlen: 

Zahnbewegung im interdisziplinären Umfeld
Kategorie: Zahnmedizin
Mögliche CME-Punkte: 2
Zertifizierende Stelle: 0
Mit freundlicher Unterstützung von teamwork
Gesponsert von mgo fachverlage GmbH & Co. KG
Weiterempfehlen: 

Ein komplexer Fall im Team gelöst
Kategorie: Zahnmedizin
Mögliche CME-Punkte: 2
Zertifizierende Stelle: 0
Mit freundlicher Unterstützung von teamwork
Gesponsert von mgo fachverlage GmbH & Co. KG
Weiterempfehlen: 


Mundgesundheit im medizinischen Kontext
Kategorie: Zahnmedizin
Mögliche CME-Punkte: 2
Zertifizierende Stelle: 0
Mit freundlicher Unterstützung von teamwork
Gesponsert von mgo fachverlage GmbH & Co. KG
Weiterempfehlen: 

Urothelkarzinom des oberen Harntraktes – Standards und neue Entwicklungen im operativen und perioperativen Management
Kategorie: Urologie
Mögliche CME-Punkte: 2
Zertifizierende Stelle: Bayerische Landesärztekammer
Mit freundlicher Unterstützung von UroForum
Gesponsert von Westermayer Verlags-GmbH; Betrag: € 300,-
Weiterempfehlen: 

Refraktionieren Schritt für Schritt
Kategorie: Ophthalmologie
Mögliche CME-Punkte: 2
Zertifizierende Stelle: Bayerische Landesärztekammer
Mit freundlicher Unterstützung von CONCEPT Ophthalmologie
Gesponsert von Westermayer Verlags-GmbH; Betrag: € 300,-
Weiterempfehlen: 

Akute myeloische Leukämie – Keine EINE Erkrankung
Kategorie: Onkologie
Mögliche CME-Punkte: 2
Zertifizierende Stelle: Bayerische Landesärztekammer
Mit freundlicher Unterstützung von onkologie heute
Gesponsert von Westermayer Verlags-GmbH; Betrag: € 300,-
Weiterempfehlen: 

Primäre Fettstoffwechselstörungen: Aktuelle Diagnose, Differenzialdiagnose und Behandlung
Kategorie: Innere Medizin
Mögliche CME-Punkte: 4
Zertifizierende Stelle: Bayerische Landesärztekammer
Mit freundlicher Unterstützung von herzmedizin
Gesponsert von Westermayer Verlags-GmbH; Betrag: € 500,-
Weiterempfehlen: 

Typische Befunde und Komplikationen nach chirurgischer Versorgung bei Netzhautablösung
Kategorie: Ophthalmologie
Mögliche CME-Punkte: 2
Zertifizierende Stelle: Bayerische Landesärztekammer
Mit freundlicher Unterstützung von CONCEPT Ophthalmologie
Gesponsert von Westermayer Verlags-GmbH; Betrag: € 300,-
Weiterempfehlen: 


Dysthymie – Definition, Diagnose und Therapie
Kategorie: Neurologie
Mögliche CME-Punkte: 2
Zertifizierende Stelle: Bayerische Landesärztekammer
Mit freundlicher Unterstützung von neuro aktuell
Gesponsert von Westermayer Verlags-GmbH; Betrag: € 300,-
Weiterempfehlen: 

Maskulinisierende Maßnahmen bei Geschlechtsinkongruenz
Kategorie: Urologie
Mögliche CME-Punkte: 2
Zertifizierende Stelle: Bayerische Landesärztekammer
Mit freundlicher Unterstützung von UroForum
Gesponsert von Westermayer Verlags-GmbH; Betrag: € 300,-
Weiterempfehlen: 

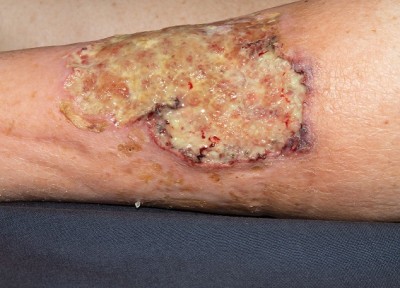
Pyoderma gangraenosum: Diagnostik und Therapie
Kategorie: Chirurgie
Mögliche CME-Punkte: 4
Zertifizierende Stelle: Bayerische Landesärztekammer
Mit freundlicher Unterstützung von chirurgische praxis
Gesponsert von Westermayer Verlags-GmbH; Betrag: € 500,-
Weiterempfehlen: 

Diagnostik des Lungenkarzinoms
Kategorie: Onkologie
Mögliche CME-Punkte: 2
Zertifizierende Stelle: Bayerische Landesärztekammer
Mit freundlicher Unterstützung von onkologie heute
Gesponsert von Westermayer Verlags-GmbH; Betrag: € 300,-
Weiterempfehlen: 


Glaukommanagement in der Schwangerschaft
Kategorie: Ophthalmologie
Mögliche CME-Punkte: 2
Zertifizierende Stelle: Bayerische Landesärztekammer
Mit freundlicher Unterstützung von CONCEPT Ophthalmologie
Gesponsert von Westermayer Verlags-GmbH; Betrag: € 300,-
Weiterempfehlen: 


Anaphylaxie: Diagnose und Therapie
Kategorie: Pädiatrie
Mögliche CME-Punkte: 2
Zertifizierende Stelle: Bayerische Landesärztekammer
Mit freundlicher Unterstützung von pädiatrische praxis
Gesponsert von Westermayer Verlags-GmbH; Betrag: € 300,-
Weiterempfehlen: 


Hitzewallungen – haben wir neue Alternativen zu Hormonersatztherapie?
Kategorie: Gynäkologie
Mögliche CME-Punkte: 4
Zertifizierende Stelle: Bayerische Landesärztekammer
Mit freundlicher Unterstützung von gynäkologische praxis
Gesponsert von Westermayer Verlags-GmbH; Betrag: € 500,-
Weiterempfehlen: 


Konservative Therapie der Adipositas
Kategorie: Innere Medizin
Mögliche CME-Punkte: 4
Zertifizierende Stelle: BLÄK
Mit freundlicher Unterstützung von internistische praxis
Gesponsert von Westermayer Verlags-GmbH; Betrag: € 500,-
Weiterempfehlen: 


Liquorverlust-Syndrom: Spontan und Postpunktionell
Kategorie: Neurologie
Mögliche CME-Punkte: 2
Zertifizierende Stelle: Bayerische Landesärztekammer
Mit freundlicher Unterstützung von neuro aktuell
Gesponsert von Westermayer Verlags-GmbH; Betrag: € 300,-
Weiterempfehlen: 

Ectopia lentis – ein neues Referenzmaß für einen wichtigen Befund
Kategorie: Ophthalmologie
Mögliche CME-Punkte: 2
Zertifizierende Stelle: Bayerische Landesärztekammer
Mit freundlicher Unterstützung von CONCEPT Ophthalmologie
Gesponsert von Westermayer Verlags-GmbH; Betrag: € 300,-
Weiterempfehlen: 


Multimodaler Therapieansatz bei Patienten mit PAVK – Möglichkeiten und Perspektiven durch spezialisierte gefäßmedizinische Rehabilitation
Kategorie: Innere Medizin
Mögliche CME-Punkte: 2
Zertifizierende Stelle: Bayerische Landesärztekammer
Mit freundlicher Unterstützung von herzmedizin
Gesponsert von Westermayer Verlags-GmbH; Betrag: € 300,-
Weiterempfehlen: 

Der Hodenhochstand. Ursachen, Diagnostik, Therapie und Langzeitfolgen
Kategorie: Pädiatrie
Mögliche CME-Punkte: 4
Zertifizierende Stelle: Bayerische Landesärztekammer
Mit freundlicher Unterstützung von pädiatrische praxis
Gesponsert von Westermayer Verlags-GmbH; Betrag: € 500,-
Weiterempfehlen: 

Metastasiertes Nierenzellkarzinom: Was spricht für die CPI/CPI und was für die CPI/TKI?
Kategorie: Urologie
Mögliche CME-Punkte: 2
Zertifizierende Stelle: Bayerische Landesärztekammer
Mit freundlicher Unterstützung von UroForum
Gesponsert von Westermayer Verlags-GmbH; Betrag: € 300,-
Weiterempfehlen: 


Therapierefraktäres Sodbrennen: Diagnostik und Therapie
Kategorie: Innere Medizin
Mögliche CME-Punkte: 4
Zertifizierende Stelle: Bayerische Landesärztekammer
Mit freundlicher Unterstützung von internistische praxis
Gesponsert von Westermayer Verlags-GmbH; Betrag: € 500,-
Weiterempfehlen: 

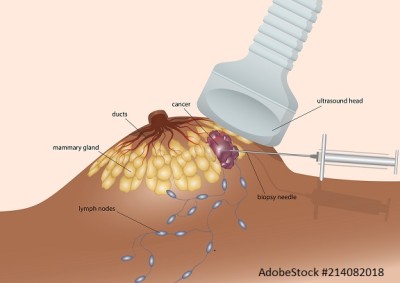
Minimalinvasive Brustbiopsie: aktueller Stand
Kategorie: Gynäkologie
Mögliche CME-Punkte: 4
Zertifizierende Stelle: Bayerische Landesärztekammer
Mit freundlicher Unterstützung von gynäkologische praxis
Gesponsert von Westermayer Verlags-GmbH; Betrag: € 500,-
Weiterempfehlen: 


Kollagenosen: Juveniler systemischer Lupus erythematodes (jSLE)
Kategorie: Pädiatrie
Mögliche CME-Punkte: 4
Zertifizierende Stelle: Bayerische Landesärztekammer
Mit freundlicher Unterstützung von pädiatrische praxis
Gesponsert von Westermayer Verlags-GmbH; Betrag: € 500,-
Weiterempfehlen: 

Thoraxtrauma und Beckenverletzungen im Kindesalter
Kategorie: Chirurgie
Mögliche CME-Punkte: 4
Zertifizierende Stelle: Bayerische Landesärztekammer
Mit freundlicher Unterstützung von chirurgische praxis
Gesponsert von Westermayer Verlags-GmbH; Betrag: € 500,-
Weiterempfehlen: 


Lebensqualität bei Gestationsdiabetes
Kategorie: Gynäkologie
Mögliche CME-Punkte: 2
Zertifizierende Stelle: Bayerische Landesärztekammer
Mit freundlicher Unterstützung von gyne
Gesponsert von Westermayer Verlags-GmbH; Betrag: € 300,-
Weiterempfehlen: 


Funktionelle neurologische Bewegungsstörungen
Kategorie: Neurologie
Mögliche CME-Punkte: 2
Zertifizierende Stelle: Bayerische Landesärztekammer
Mit freundlicher Unterstützung von neuro aktuell
Gesponsert von Westermayer Verlags-GmbH; Betrag: € 300,-
Weiterempfehlen: 


Eisen als Biofaktor: Zwischen Mangel und Überschuss
Kategorie: Onkologie
Mögliche CME-Punkte: 2
Zertifizierende Stelle: Bayerische Landesärztekammer
Mit freundlicher Unterstützung von onkologie heute
Gesponsert von Westermayer Verlags-GmbH; Betrag: € 300,-
Weiterempfehlen: 

Kontroversen zur fokalen Therapie des Prostatakarzinoms
Kategorie: Urologie
Mögliche CME-Punkte: 2
Zertifizierende Stelle: Bayerische Landesärztekammer
Mit freundlicher Unterstützung von UroForum
Gesponsert von Westermayer Verlags-GmbH; Betrag: € 300,-
Weiterempfehlen: 

Chirurgische Optionen bei durchgreifendem Makulaforamen
Kategorie: Ophthalmologie
Mögliche CME-Punkte: 2
Zertifizierende Stelle: Bayerische Landesärztekammer
Mit freundlicher Unterstützung von CONCEPT Ophthalmologie
Gesponsert von Westermayer Verlags-GmbH; Betrag: € 300,-
Weiterempfehlen: 

Behandlung der Multiplen Sklerose und autoimmunen Komorbiditäten
Kategorie: Neurologie
Mögliche CME-Punkte: 2
Zertifizierende Stelle: Bayerische Landesärztekammer
Mit freundlicher Unterstützung von neuro aktuell
Gesponsert von Westermayer Verlags-GmbH; Betrag: € 300,-
Weiterempfehlen: 


Was kann Cannabidiol bei der Behandlung der epileptischen Enzephalopathie im Kindesalter?
Kategorie: Pädiatrie
Mögliche CME-Punkte: 4
Zertifizierende Stelle: Bayerische Landesärztekammer
Mit freundlicher Unterstützung von pädiatrische praxis
Gesponsert von Westermayer Verlags-GmbH; Betrag: € 500,-
Weiterempfehlen: 


Prähospitale Schlaganfallversorgung – der erste wichtige Schritt für ein optimales klinisches Ergebnis
Kategorie: Neurologie
Mögliche CME-Punkte: 2
Zertifizierende Stelle: Bayerische Landesärztekammer
Mit freundlicher Unterstützung von neuro aktuell
Gesponsert von Westermayer Verlags-GmbH; Betrag: € 300,-
Weiterempfehlen: 


Psychosomatisch-geburtshilfliche Basics – ein Update zu Hyperemesis und Frühgeburtlichkeit
Kategorie: Gynäkologie
Mögliche CME-Punkte: 4
Zertifizierende Stelle: Bayerische Landesärztekammer
Mit freundlicher Unterstützung von gynäkologische praxis
Gesponsert von Westermayer Verlags-GmbH; Betrag: € 500,-
Weiterempfehlen: 

Medikamentöse Therapie bei nichtalkoholischer Fettlebererkrankung (NAFLD)
Kategorie: Innere Medizin
Mögliche CME-Punkte: 4
Zertifizierende Stelle: Landesärztekammer Bayern
Mit freundlicher Unterstützung von internistische praxis
Gesponsert von Westermayer Verlags-GmbH; Betrag: € 500,-
Weiterempfehlen: 

Die Korrekturmöglichkeiten des Astigmatismus bei der Kataraktoperation
Kategorie: Ophthalmologie
Mögliche CME-Punkte: 2
Zertifizierende Stelle: Bayerische Landesärztekammer
Mit freundlicher Unterstützung von CONCEPT Ophthalmologie
Gesponsert von Westermayer Verlags-GmbH; Betrag: € 300,-
Weiterempfehlen: 

Das hepatozelluläre Karzinom (HCC): Leitliniengerechte interventionelle Therapieoptionen
Kategorie: Onkologie
Mögliche CME-Punkte: 2
Zertifizierende Stelle: Bayerische Landesärztekammer
Mit freundlicher Unterstützung von onkologie heute
Gesponsert von Westermayer Verlags-GmbH; Betrag: € 300,-
Weiterempfehlen: 


Verhaltenstherapeutische Diagnostik und Behandlung der Migräne
Kategorie: Neurologie
Mögliche CME-Punkte: 2
Zertifizierende Stelle: Bayerische Landesärztekammer
Mit freundlicher Unterstützung von neuro aktuell
Gesponsert von Westermayer Verlags-GmbH; Betrag: € 300,-
Weiterempfehlen: 


Chronische Hepatitis C: Eine Erfolgsgeschichte auch für Kinder und Jugendliche
Kategorie: Pädiatrie
Mögliche CME-Punkte: 2
Zertifizierende Stelle: Bayerische Landesärztekammer
Mit freundlicher Unterstützung von pädiatrische praxis
Gesponsert von Westermayer Verlags-GmbH; Betrag: € 300,-
Weiterempfehlen: 

Erfolgsfaktoren für die Therapie
Kategorie: Zahnmedizin
Mögliche CME-Punkte: 4
Zertifizierende Stelle: 0
Mit freundlicher Unterstützung von teamwork
Gesponsert von mgo fachverlage GmbH & Co. KG
Weiterempfehlen: 

Muss es immer die Füllung sein?
Kategorie: Zahnmedizin
Mögliche CME-Punkte: 2
Zertifizierende Stelle:
Mit freundlicher Unterstützung von teamwork
Gesponsert von mgo fachverlage GmbH & Co. KG
Weiterempfehlen: 

Scanner: Must-have in der Mehrbehandler-Praxis
Kategorie: Zahnmedizin
Mögliche CME-Punkte: 2
Zertifizierende Stelle: 0
Mit freundlicher Unterstützung von teamwork
Gesponsert von mgo fachverlage GmbH & Co. KG
Weiterempfehlen: 

Implantat und Alloplast: Synergie im unteren Frontzahnbereich
Kategorie: Zahnmedizin
Mögliche CME-Punkte: 0
Zertifizierende Stelle: 0
Mit freundlicher Unterstützung von BDIZ EDI konkret
Weiterempfehlen: 

Karies meets Pulpa - Wie weit kann man gehen?
Kategorie: Zahnmedizin
Mögliche CME-Punkte: 2
Zertifizierende Stelle: 0
Mit freundlicher Unterstützung von teamwork
Gesponsert von mgo fachverlage GmbH & Co. KG
Weiterempfehlen: 

Die Äquilibrierungsschiene mit anteriorer Führung
Kategorie: Zahnmedizin
Mögliche CME-Punkte: 2
Zertifizierende Stelle: 0
Mit freundlicher Unterstützung von teamwork
Gesponsert von mgo fachverlage GmbH & Co. KG
Weiterempfehlen: 

One-tooth-One-time-Technik – Ergebnisse nach zwei Jahren
Kategorie: Zahnmedizin
Mögliche CME-Punkte: 2
Zertifizierende Stelle: KZVB
Mit freundlicher Unterstützung von BDIZ EDI konkret
Gesponsert von Straumann Group
Weiterempfehlen: 

Die One- Tooth-One-Time (1T1T)-Technik ermöglicht einen unkomplizierten Ersatz fehlender Zähne im Seitenzahnbereich.
Die Punkte für diese Fortbildung werden nicht automatisch übertragen. Bitte reichen Sie die Punkte gesondert mit Ihrem Zertifikat ein.
Registrierung
Registrieren Sie sich jetzt
in wenigen Schritten!
Login für Fachkreise
Um Fortbildungen bearbeiten zu können, müssen Sie sich einloggen.

